バイオイメージング ISSN 2760-1765 (Online)学会誌
学会誌紹介
日本バイオイメージング学会は、1991年に設立された、国内外で唯一のバイオイメージング分野に特化した学術団体です。本学会は、新しいイメージング法の開発ならびにその生物学への応用に関する研究を対象として、工学から生物学・医学までの極めて幅広い学際的な研究交流を目指しており、各分野のバイオイメージング研究のリーダー的存在となっています。1997年から日本学術会議会員推薦団体として認定されており、わが国の医学・薬学・理学・農学・工学を統合した学際的研究分野の発展に貢献しています。
本学会は、国際英文誌”Bioimages”(1993年創刊; J-STAGE登載済)と並んで、1992年から和文誌「バイオイメージング」を発行しています。日本バイオイメージング学会の高い学際性に基づき、バイオイメージングおよび関連領域に関する学術的交流を推進することを目的としています。2025年からは、学会の情報発信力や学術的価値をより一層高めるために、紙冊子での発行を終了し、オンライン形式に移行しました。これは、従来の紙媒体の役割を超えて、学術的交流をさらに活性化させる取り組みの一環です。
アーカイブ
-
2025年5月発刊 2025年34巻1号(通巻96号)
-
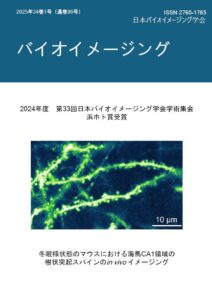
表紙:冬眠様状態のマウスにおける海馬CA1領域の樹状突起スパインのin vivo イメージング
堤香琳、榎木亮介、曽我公平、根本知己、高橋泰伽
(第33回学術集会ベストイメージング賞浜ホト賞)一部の動物は冬季に体温や代謝を低下させる冬眠状態となるが、その際の脳の神経細胞の変化は十分に解明されていない。本研究では冬眠時の脳のメカニズムを解明するため、低体温状態におけるマウス脳の神経細胞の活動と形態を観察・解析する実験系を構築した。さらに、近年、冬眠しないマウスにおいて、視床下部AVPe領域のQ-neuronを活性化することで、低体温・低代謝状態(QIH)を誘導できることが報告されている。そのためQIHを誘導したマウスを用い、二光子顕微鏡によるin vivoイメージングを行い、海馬CA1領域の樹状突起スパインの形態変化を経時的に解析した。実験には、興奮性神経細胞特異的にEYFPを発現するThy1-EYFP-HマウスおよびQrfp-iCreマウスを使用し、視床下部AVPe領域にアデノ随伴ウイルスを注入し、クロザピン投与によりQ-neuronを活性化した。さらに、頭蓋骨の一部を除去し、大脳皮質を吸引除去して海馬を露出させ、ラット用カニューレをマウス用に再設計したものを埋め込んだ。約3週間後にQIH誘導前後の海馬スパイン形態変化をin vivo二光子イメージング手法を用いて観察した。その結果冬眠様状態での海馬 CA1 スパインは覚醒時と比較して縮小・消失する傾向が示唆された。冬眠様状態が誘導されたことでエネルギー消費を抑制するために、生命活動に最低限必要なスパイン以外が刈り込まれた可能性があると考えており、今後さらに追加の検証を行う予定である。
-
2024年9月発刊 2024年33巻2号(通巻95号)
-
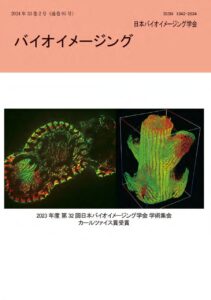
表紙:サンゴと褐虫藻の3次元構造の観察・可視化
横田秀夫、中村佐紀子、山下洋
(第32回学術集会ベストイメージング賞カールツァイス賞)造礁性サンゴは、ポリプが炭酸カルシウムの骨格を形成すると共に、内部に褐虫藻を共生することにより、光合成やCO2 の吸収を行っている。このサンゴは、CO2を光合成により吸収するのみならず、その骨格に炭酸カルシウムとして固定化することから、地球温暖化に関連する一つの要因であるCO2を固定化する現象として注目を集めている。一方、サンゴの成長には時間を要し、人工的に栽培することが容易ではない。その要因の一つが造礁サンゴの内部構造と褐虫藻の3次元空間配置が不明なことにある。そこで、造礁サンゴのウスエダミドリイシ(Acropora tenuis) の先端から6mmの範囲を観察した。観察には、試料の上端を機械的に切断し、その断層画像を観察することをくり返すことにより、試料の断層情報を自動的に取得する3次元内部構造顕微鏡(3D-ISM:RIKEN)に共焦点ユニットW1(YOKOGAWA)の内部結像系を3 分岐同時観察可能に改造したシステム(525/50nm、685/40nm)を用いて2 台の高感度カメラ(Andor, Sona-11)により撮影した。切断厚さ2 μm、画像分解能1.5 μm で5.7x3x3mm の広範囲を観察し、3 次元画像解析ソフトウエアVCAT5(RIKEN)を用いて3 次元画像を構築した。
褐虫藻の葉緑体由来の自家蛍光とサンゴの自家蛍光を観察し、サンゴ内部の3 次元構造に加え褐虫藻の3 次元局在を明らかにした。 -
2024年7月発刊 2024年33巻1号(通巻94号)
-

表紙:気孔孔運動を制御する膜交通因子の超解像イメージングと定量的画像解析
市田 まなみ 、射場 厚、加藤 薫、光山 統泰、檜垣 匠
(第32回学術集会ベストイメージング賞ニコン賞)植物は気孔と呼ばれる一対の孔辺細胞で囲まれた空隙を通してガス交換や蒸散を行っており,周囲の環境に応じてその開度を適切に調節している.私たちは気孔開口を制御する膜交通因子PATROL1を手掛かりに,気孔応答の細胞生物学的な制御機構を明らかにしてきた.PATROL1は気孔開口に異常を示すシロイヌナズナ変異体の原因遺伝子として同定された.PATROL1は動物の神経細胞でシナプス小胞と細胞膜を橋渡しすることで神経伝達物質の放出に寄与するMunc13の主要な役割を担うMUNドメインと類似したドメインを持つ.シロイヌナズナの気孔開口に中心的な役割を果たす細胞膜型H+-ATPaseであるAHAlの細胞内局在をpatrol1変異体背景で観察したところ,本来の細胞膜局在が損なわれて異常な内在化が生じることが判明した.またGFP-PATROL1の細胞内局在を調べたところ,孔辺細胞の細胞膜直下にドット状の構造が標識された.このドット状の構造は細胞膜直下に突如として出現し,数秒間同じ場所に留まった後に消失するといった特徴的な動態を示した.以上の結果から,PATROL1はAHAlの細胞膜輸送を担うことで気孔開口を正に制御することが示唆された.画像は,シロイヌナズナ孔辺細胞の表層におけるGFP-PATROL1の動態を高速超解像顕微鏡(CSU-W1 SoRa)により捉えたものである.100 ミリ秒露光で40秒間(400フレーム)撮影した動画像をImageJマクロTemporal-Color Codeを用いて時間変化を疑似カラーで表示している.
-
2023年10月発刊 2023年32巻2号(通巻93号)
-
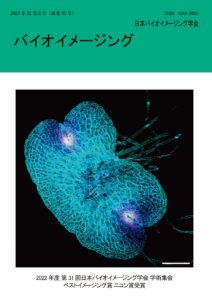
表紙:活性酸素種生成酵素 NOX/Rboh によるゼニゴケの細胞分裂・分化制御機構のイメージング解析
山下 優音、萩原 雄樹、橋本 研志、朽津 和幸
(第31回学術集会ベストイメージング賞ニコン賞)酸素呼吸や光合成の過程で不可避的に生成される活性酸素種(ROS)の毒性は広く知られている。一方で、NADPH oxidase (NOX)による積極的な ROS 生成は広範な生物種で多様な機能を果たす。植物の NOX/Respiratory burst oxidase homolog (Rboh)は ROS を積極的に生成することにより植物免疫、環境ストレス応答、先端成長・発生、プログラム細胞死などに関与すると考えられている。近年、動物や菌類を含む種々の真核生物において、NOX によるROS 生成が細胞分裂・分化制御に関与する可能性が議論されているが、標的因子や下流の分子ネットワークは多くが未解明である。
遺伝的冗長性が低いモデル植物であるゼニゴケ(Marchantia polymorpha)は 2 種の Rboh (MpRbohA, MpRbohB)を持ち、両者は共に形態形成の基礎をなす頂端分裂組織(幹細胞領域)に発現する。生物が持つ全ての NOX を欠損させた最初の例と思われる、二重変異体 MprbohA/Bko は細胞分裂・分化の著しい異常による細胞塊様の形態を示し、ゼニゴケにおいても NOX の細胞分裂・分化制御における重大な寄与が示唆された。そこで種々のイメージング技術を駆使して、Mprboh 変異体における微小管、細胞膜マーカー発現株を用いた細胞周期や細胞分裂パターンの解析を進めており、これらの結果を統合することで、真核生物において共通する NOX による細胞分裂・分化制御機構の解明を目指している。図の説明
ゼニゴケの分裂組織におけるS 期細胞核のイメージング
2 日齢のゼニゴケ全体を共焦点レーザー顕微鏡によりZ スタック撮影し、合成した画像。(スケールバー : 200 μm )
ゼニゴケには、S 期細胞核に取り込まれるチミジン類縁体 5-ethynil-2′-deoxyuridine (EdU)を処理したのち、Alexa Fluor 488 (疑似カラー : マゼンタ)で蛍光標識するとともに、細胞壁を SCRI Renaissance Stain 2200 (疑似カラー : シアン)で染色した。標識された、細胞分裂が活発な細胞が、湾入部の分裂組織に集中している。 -
2023年7月発刊 2023年32巻1号(通巻92号)
-

表紙:高分子超薄膜(ナノシート)を活用したマウス脳の広視野in vivo 二光子イメージング
高橋 泰伽、張 宏、揚妻 正和、鍋倉 淳一、大友 康平、岡村 陽介、根本 知己
(第31回学術集会ベストイメージング賞浜松ホトニクス(晝馬)賞)脳のはたらきを理解する上では、脳組織に存在する細胞一つの活動だけではなく、多領域の細胞群を同時に観察することによって脳機能を担うネットワーク全体の活動を理解する必要がある。我々は、生きたままのマウス脳内の神経細胞を広範囲かつ深部領域において可視化することを目指し、高い柔軟性、接着性、光透過性および生体適合性を有するナノシートをマウスの頭蓋骨の代替物として活用する広範囲観察窓の作成法を開発した。
二光子励起蛍光顕微鏡を用いて、マウス生体脳の神経細胞の高解像度観察を行うためには、光の散乱・吸収の原因となる頭蓋骨を除去し、観察対象とする脳領域の直上にカバーガラスを設置することで、光透過性を高めた観察窓を作成する必要がある。しかし、広範囲の頭蓋骨を除去する場合、出血や炎症等が生じやすい。また、カバーガラスは硬質かつ平坦であるために脳の曲率に対応できない。そのため、広範囲観察窓の素材として使用した場合は生体脳を強く圧迫するために、脳内の血液や脳脊髄液等の循環が阻害されてしまう。これらのことから、一般的な観察窓の作成範囲は直径数mm 程度であった。
本研究では、低屈折率かつ高い光透過性を有するフッ素樹脂CYTOP を主な素材とする厚さ百nm 前後のナノシートを活用することで広範囲観察窓を実現した。生体脳への応用にあたり、脳との接着面に生体適合性高分子のpolyethylene oxide(PEO)を添加することで接着面を親水化処理したPEO-CYTOP ナノシートを活用した。これにより、生体脳組織に対する接着力を高め、ナノシートの高い止血効果を実現した。さらに、ナノシートの柔軟性も併せて活用することで、従来法の課題であった脳表面への機械的な圧力を低減した新規広範囲観察窓の作成法を確立し、頭頂部広域における大脳皮質全層の神経細胞のin vivo 二光子イメージングを実現した。 -
2022年8月発刊 2022年31巻2号(通巻91号)
-
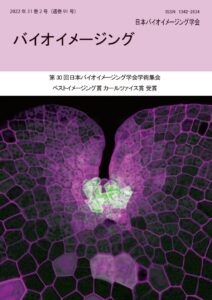
表紙:ゼニゴケの細胞分裂組織におけるCa2+動態の時空間パターンの解析:自発的Ca2+スパイクの発見
吉沢 優花、橋本 研志、萩原 雄樹、山下 優音、朽津 和幸
(第30回学術集会ベストイメージング賞カールツァイス賞)種々の刺激により誘導される細胞内Ca2+濃度変化の時空間パターンは、生体の情報伝達系の根幹をなすが、発生・形態形成における自発的な細胞内Ca2+動態変化やそのメカニズム、生理的意義は不明な点が多く、特に植物ではほとんど理解されていない。私たちは、体制が単純なモデル植物ゼニゴケの細胞内Ca2+動態のライブイメージング系を構築し、2020 年度日本バイオイメージング学会学術集会において仮根の極性先端成長におけるCa2+の濃度勾配と振動的変化について報告した。
植物の成長は、特定の頂端分裂組織における細胞分裂と、細胞伸長(体積の増大)により制御される。ゼニゴケMarchantia polymorpha 葉状体の分裂組織は、湾入した形状の中央に幹細胞があり、それに隣接する分裂細胞を起点として二次元方向に成長すること、また、被子植物の頂端分裂組織と異なり幹細胞が表層に位置することから、共焦点顕微鏡や多光子レーザー顕微鏡による細胞レベルのイメージングが比較的容易である。
ゼニゴケの分裂組織において、一部の特定の細胞において、間隔をおいて自発的Ca2+スパイク様の一過的なCa2+濃度上昇が繰り返される新規の現象を見出した。幹細胞、分裂細胞、さらにその周辺と、細胞毎にその濃度上昇の頻度に違いが認められた。Ca2+濃度変化のパターンと、分裂組織及びその周辺における細胞分裂・分化・幹細胞の維持等の細胞の運命決定との関係、分子機構や生理的意義の解明を目指して解析を進めている。また細胞分裂・分化に異常を示す、活性酸素種生成酵素NADPH oxidase/Rboh 遺伝子等の変異体を用いた比較解析により、細胞の分裂や運命決定とCa2+-ROS シグナルネットワークとの関係の解析を進めている。 -
2022年6月発刊 2022年31巻1号(通巻90号)
-
表紙:広視野型2光子励起ライトシート顕微鏡の開発
齋藤卓、今村健志
(第30回学術集会ベストイメージング賞 浜ホト賞)
近赤外光を利用した 2 光子励起現象の新たな利活用によって、(1)観察対象への低い光毒性、(2)広い視野範囲、(3)高い空間分解能、の 3 条件の向上を達成する光シート蛍光顕微鏡を開発した。2 光子励起顕微鏡は、生体に優しい蛍光イメージングを行うための装置であるが、2 光子励起を起こすためには狭い範囲に光を集中させる必要があるために励起範囲(光シート顕微鏡では “ 視野範囲 ”)が狭くなってしまうという特性がある。本研究ではこれを解決するためにレーザー集光範囲を光軸方向に伸長させる(励起範囲を広げる)ベッセルビーム形成ユニットを作製した。このユニットを使うことで、分解能を 2-3μm(10 倍拡大率、開口数 0.3 の対物レンズを利用した場合)に保ったまま、ビーム長を 600-1000μm の範囲で変化させることができることを示した。この光学ユニットを用いて視野性と解像度に優れた 2 光子励起光シート蛍光顕微鏡を構築し、小型魚類(メダカ)の観察に応用し、メダカ稚魚での全身での脈管系イメージング、全脳神経細胞イメージングに成功した。本技術により、多様な生物の成長過程を細胞レベルの高分解能で、生きたまま観察することができるようになる。
-
2021年8月発刊 2021年30巻2号(通巻89号)
-
表紙:光スイッチング蛍光タンパク質(Kohinoor2.0)による、長時間・高速超解像イメージング
野間涼平、和沢鉄一、宇上周作、杉浦一徳、鷲尾隆、永井健治
(第29回学術集会ベストイメージング賞 ニコン賞)
光スイッチング蛍光タンパク質(RSFP; reversibly photoswhitchable fluorescent protein)は光照射により蛍光の明状態(ON)と暗状態(OFF)を可逆的に制御できる蛍光タンパク質であり、光の回折限界を超えた空間分解能を持つ超解像イメージング法などに応用されている。我々が以前開発したRSFPであるKohinoorは、405 nmの光照射によりON状態からOFF状態へ遷移し、488 nmの光照射によりOFF状態からON状態へ遷移とON状態の蛍光励起が起こりピーク波長518 nmの蛍光を発する、ポジティブ型RSFPである(Tiwari etal., Nat. Methods, 12, 515-518, 2015)。Kohinoorを用いて光毒性の低い超解像イメージング「SPoD-OnSPAN」に成功した(Wazawa et al., Microscopy, 67, 89-98, 2018)ものの、蛍光強度などの光特性が不十分であったため、長時間、もしくは裔速超解像イメージングを行うことは困難であった。そこで本研究では、Kohinoorに改良を加え、変異体 Kohinoor2.0の開発を行った。Kohinoor2.0の光特性の評価を行った結果、Kohinoor2.0はKohinoorと比べて、2.6倍裔い蛍光強度、2.5倍速い発色団形成速度、そして1.5倍速いOFFスイッチングスピードを示した。さらに、Kohinoor2.0を用いてCOS7細胞のSPoD-OnSPAN超解像イメージングを行ったところ、4時間に及ぶアクチンフィラメントの動態を捉えることに成功した。さらに、 0.5秒の時間分解能でミトコンドリアの超解像イメージングを行い、従来の蛍光顕微鏡では捉えられなかったミトコンドリアの融合、分裂などの動態の圏解像観察に成功した(Wazawa et al, Microscopy, in press)。Kohinoor2.0は、細胞小器官や分子の微細な動態の可視化に有用であると期待される。
【図の説明】
上図:アクチンフィラメントの長時間SPoD-OnSPAN超解像イメージング
COS7細胞にLifeAct-Kohinoor2.0を発現させた後、3分おき、4時間にわたるSPoD-OnSPAN
超解像イメージングを行った。
下図:ミトコンドリアの高速SPoD-OnSPAN超解像イメージング
COS7細胞に(COX8)x2-Kohinoor2.0を発現させた後、時間分解能0.5秒でSPoD-OnSPAN超解像イメージングを行った。上からミトコンドリアの融合、分裂、瞬間的な融合分裂、Nano tunnelingの動態を高解像観察したものである。目次
- 第30回日本バイオイメージング学会学術集会 … 9
- ご案内 … 2
- 第30回学術集会プログラム … 5
- 要旨 … 27
- 発表者索引 … 97
- 総会資料 … 103
- 学会定款 … 114
-
2021年6月発刊 2021年30巻1号(通巻88号)
-
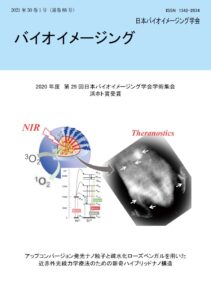
表紙:アップコンバージョン発光ナノ粒子と疎水化ローズベンガルを用いた近赤外光線力学療法のための新奇ハイブリッドナノ構造
手塚 景子、梅澤 雅和、劉 得懿、野村 洸希、大久保 喬平、邱 信程、上村 真生、曽我 公平
(第29回学術集会ベストイメージング賞 浜ホト賞)
光を用いて病変を死滅させる光線力学療法 (photodynamic therapy: PDT) が、がんなどの疾病治療に新しい選択肢をもたらしている。特に生体透過性の高い近赤外光で誘導されるPDT は、生体深部の病変の処置に応用できる手法として期待される。
著者らは2005 年頃から、近赤外光励起下で長波長近赤外光(1550 nm)及びアップコンバージョン(UC)による可視光の両方を発するUCナノ粒子(upconversion nanoparticle: UC-NP)を、PDTプローブとして応用するためのナノ材料設計を追究してきた(Chem. Lett. 46, 1076-1078 (2017), Theranostics 8, 1435-1448 (2018))。UC-NPを用いた近赤外PDTプローブの利点は、色素を励起してPDT 効果を誘導するための可視光の発光源としてのUC-NPを、色素のごく近傍に配置できることにある。
本研究では、粒子サイズ10 nm 以下と超微小で腎排泄の期待されるUC-NPを、PDT 色素と生分解性ポリカプロラクトン(PCL)とポリエチレングリコール(PEG)のブロック共重合体ミセルのコア内部に内包する新奇のハイブリッドナノ構造を設計し、近赤外光(波長 980 nm)照射下でのPDT 効果を報告した。PDT 色素として、緑色光(波長500 ~600 nm)を吸収して一重項酸素(細胞死を誘導できる活性酸素)を産生するローズベンガル(RB)を用いた。このRBに炭化水素鎖を導入し、PCLコア内部のUC-NP近傍であり、かつRBの毒性を低減できるPEG 鎖の内側に効率良く内包することに成功した。
ハイブリッドナノ構造に導入したUC-NPは、生体深部のイメージングが可能な長波長近赤外(波長1550 nm)の蛍光も発する。そのため、報告した新奇PDTプローブは標的病変の位置をリアルタイムで確認し、イメージング(診断)をしながら治療 (PDT) のできる「セラノティックス (theranostics)」プローブとして活用できる。超微小UC-NP及びハイブリッドナノ構造の合成方法を、光学・化学的特性やPDT効果と合わせてACS Appl. Bio Mater. 4, 4462-4469 (2021)にて詳細に論述したのでご参照いただきたい。目次
- 表紙の図(2020年度 第29回学術集会浜ホト賞受賞)
- アップコンバージョン発光ナノ粒子と疎水化ローズベンガルを用いた近赤外光線力学療法のための新奇ハイブリッドナノ構造/手塚景子・梅澤雅和・劉 得懿・野村洸希・大久保喬平・邱 信程・上村真生・曽我公平 … 1
- 2021 年度 第 30 回日本バイオイメージング学会 「学術集会」ならびに「公開講座」開催のお知らせ/田中直子・細谷夏実 … 2
- 2020年度 第29回日本バイオイメージング学会学術集会を終えて/根本知己 … 5
-
2020年11月発刊 2020年29巻1・2号(通巻86・87号)
-
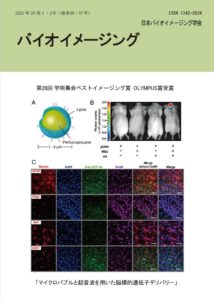
表紙:マイクロバブルと超音波を用いた脳標的遺伝子デリバリー
小俣 大樹、萩原 芙美子、宗像 理紗、島 忠光、影山 彩織、鈴木 悠乃、丸山 一雄、鈴木 亮
(第28回学術集会ベストイメージング賞 OLYMPUS賞)
血液脳関門は血液と脳実質の間の物質移動を厳密に制御しているため、多くの薬物は脳実質へと移行できない。そのため、アルツハイマー病やパーキンソン病などに対する遺伝子治療の実現のためには、安全かつ効率的に脳実質へとプラスミドDNA や核酸を送達できる技術の開発が必要となる。近年、マイクロバブル (気体を脂質などで覆い安定化した微小気泡) と超音波を用いた脳実質への薬物送達技術が注目されている。超音波照射に伴うマイクロバブルの振動や収縮、膨張といった機械的作用が血管内皮細胞間の密着結合を緩めることで、脳実質への薬物送達が可能になると考えられている。これまでに我々は、血中滞留性に優れたマイクロバブルを開発し、超音波を併用することで、in vitro およびin vivo においてプラスミドDNA デリバリーが可能であることを報告してきた (J. Control. Release, Suzuki.R. et. al., 142, 245-250, 2010) 。そこで、この技術を用いて脳へのプラスミドDNA デリバリーを試みた。その結果、マイクロバブルと超音波を用いることで、プラスミドDNA をデリバリーしたことによる脳選択的なタンパク質発現を確認した。また、血管内皮細胞のみでなく、脳実質細胞でのプラスミドDNA 導入に由来するタンパク質発現を確認した。これらの結果から、マイクロバブルと超音波の併用は脳選択的にプラスミドDNA をデリバリーできることが明らかとなった。
A マイクロバブル
パーフルオロプロパンガスをリン脂質で覆った構造を持ち、高い安定性、血中滞留性を示す。
B 脳への選択的なプラスミドDNA デリバリー
マウスにマイクロバブルとルシフェラーゼ発現プラスミドDNA を静脈内投与し、経頭蓋的に脳に超音波を照射した。1 日後、ルシフェリンを投与し、ルシフェラーゼの発光をin vivo imaging systemで観察した。
C プラスミドDNA 導入細胞の評価
マウスにマイクロバブルとGFP 発現プラスミドDNA を静脈内投与し、経頭蓋的に脳に超音波を照射した。1 日後、脳を摘出し、坑GFP 抗体を用いた免疫染色を行い共焦点顕微鏡によりGFP 発現細胞を観察した。種々の細胞のマーカーとして、GFAP (アストロサイト)、Olig2 (オリゴデンドロサイト)、Iba1 (ミクログリア)、CD31 (血管内皮細胞)、NeuN (神経細胞) をそれぞれ染色した。スケールバー:50 μm。目次
- 表紙の図(第27回学術集会ベストイメージング賞OLYMPUS賞受賞)
- マイクロバブルと超音波を用いた脳標的遺伝子デリバリー/小俣大樹・萩原芙美子・宗像理紗・島 忠光・影山彩織・鈴木悠乃・丸山一雄・鈴木 亮 … 1
- 2019年 第28回日本バイオイメージング学会学術集会を終えて(同時開催:The 6th International Symposium on Bioimaging)/鈴木 亮 … 2
- The 6th International Symposium on Bioimaging/第28回日本バイオイメージング学会学術集会における“Women in Science”を終えて/日本バイオイメージング学会男女共同参画委員会 洲崎悦子・田中直子・橋本香保子・朽津和幸・樋口ゆり子・加藤有介 … 5
- 第29回日本バイオイメージング学会学術集会 … 9
- ご案内 … 11
- 第29回学術集会プログラム … 13
- 要旨 … 23
- 発表者索引 … 61
- 総会資料 … 65
- 学会定款 … 79
-
2019年9月発刊 2019年28巻2号(通巻85号)
-
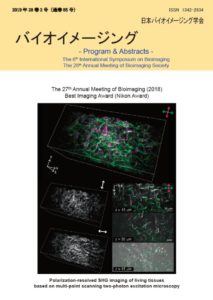
Figure on the front cover: Polarization-resolved SHG imaging of living tissues based on multi-point scanning two-photon excitation microscopy
Ai Goto, Kohei Otomo, Tomomi Nemoto
The 27th Annual Meeting of Bioimaging (2018) Best Imaging Award (Nikon Award)
Second harmonic generation (SHG) is a non-linear optical process that can be applied for bioimaging. Two photons from ultrashort high-peak-power laser pulses are converted to a single photon, and its wavelength becomes halved via SHG processes. SHG signals are strongly observed from individual non-centrosymmetric molecules, especially when they are arranged in a crystalline array, such that SHG signals are frequently generated by endogenous fiber-like structures like supercoiled collagens fibers and thick myosin filaments. Moreover, the probability of SHG occurring largely depends on the relative orientation between the polarization of the incident light beam and the orientation axis of the targeted molecules. Therefore, polarization-based SHG imaging, the concept of which is based on analyzing the polarization anisotropy of SHG light or SHG signal intensity as a function of the polarization state of the incident light beam, can be implemented to reveal the structural assembly information of targeted molecules and has been used as a tool for medical and biological analyses. However, most of polarization-based SHG microscopy requires a specialized optical setup to irradiate the sample with the excitation laser light beam, capture, and/or analyze the SHG light signals.
Simple SHG images can be acquired by using a laser scanning microscope equipped with an ultrashort high-peak-power laser light source such as a conventional two-photon excitation fluorescence microscope (TPM). Since most of TPM systems employ a single-point laser scanning method using moving mirrors, their temporal resolution depends on the speed of the physical movement of the mirrors. However, since early 21st century, multi-point laser scanning methods have been attempted to achieve high-speed TPM imaging. Recently, a TPM system equipped with a spinning-disk confocal scanning unit (TPM-SD), which incorporates a micro-lens array disk and a Nikpow disk containing a set of confocal pinholes, has been developed. However, the insufficient energy of conventionally-used mode-locked titanium-sapphire (Ti-Sa) laser light sources restricted the effective field of view (FOV) of TPM utilizing the spinning-disk scanning unit (TPM-SD) to a narrow region. Although Shimozawa et al. modified spinning-disks to increase near infrared laser light power throughput, the system using a Ti-Sa laser light source could use a 10% region of the effective area of the detector, which corresponded to approximately 40 μm diameter FOV with a 60× objective lens [Shomozawa et al., Proc. Natl. Acad. Sci. USA, 2013]. In order to enlarge the FOV further, we introduced a higher-peak-power ytterbium (Yb)-based laser light source to the TPM-SD system, achieving approximately 10-times larger FOV [Otomo et al., Anal. Sci., 2015].
In this study, we introduced a polarization-resolving detection methodology for the TPM-SD system [Goto et al., Front. Phys., 2019], enabling high-speed SHG imaging of living tissue to reveal the structural orientation of collagen fibers. By utilizing developed system, we visualized three-dimensional objects from cross-sectional images of non-labeled biological specimens. We irradiated a linearly polarized beam to a fixed mouse skin sample from the dermal side and acquired a pair of orthogonally-resolved polarization SHG images from the surface to a depth of 50-μm. As shown in a figure on the front cover, complicated collagen fiber network structures were visualized, and the signal ratios between the two channels appeared to reflect their orientations. In addition, we also demonstrated in vivo polarization-resolved SHG imaging of the collagen fibers in the mouse skeletal muscles at video-rate temporal resolution. This technique will enable monitoring of the distribution of biological molecular orientations responding to intracellular dynamics with a superior temporal resolution.
Contents
- Organization … 1
- Map … 4
- General Information … 9
- Speakers’ Instruction … 11
- Program September 21, 2019 … 20
- Program September 22, 2019 … 23
- Program September 23, 2019 … 25
- Abstracts … 29
- Acknowledgements … 114
- Author Index … 119
- Annual General Meeting of Bioimaging Society … 127
- (In Japanese)(総会資料)学会定款 … 140
-
2019年6月発刊 2019年28巻1号(通巻84号)
-
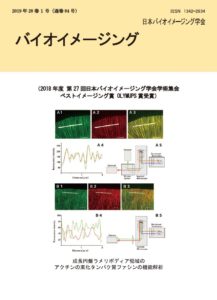
表紙: 成長円錐ラメリポディア領域のアクチンの束化タンパク質ファシンの機能解析
田中みなみ、藤井裕紀、平野和巳、石川良樹、岡嶋孝治、加藤薫
(第 27 回学術集会ベストイメージング賞 OLYMUPS 賞)
成長円錐は伸長中の軸索や樹状突起の先端に見られる構造で、水かきを持った蛙の手の様な形をしている。指の部分にはフィロポディアが、水かきの部分には、ラメリポディアが存在する。フィロポディアではアクチンの束が、ラメリポディアにはアクチンの網目が細胞骨格である。
ファシンは、アクチンの束化タンパクで、フィロポディアのアクチン束を形成する。フィロポディアでは、数多くの研究報告がある。ラメリポディアにも、ファシンは一定量が存在し、近年は、がんの転移マーカーとして注目されているが、ラメリポディア領域のファシンの機能は未解析だった。その理由の一つは、ラメリポディアのファシンは可視化が難しいからである。
我々は、超解像顕微鏡(SIM)を用いて、ラメリポディア領域のファシンの可視化に成功した。さらに、アクチンとファシンの共局在を、2 カメラ SIM を用いて、30nm 以下の精度で捉えた。2 つの蛍光色素の分布を 2 つのカメラで同時に捉え、アクチンとファシンの共局在を高精度で捉えることができた。
この実験系でファシンの乖離に伴うアクチン骨格の変化を観察した。ファシンのアクチンからの乖離により、アクチン繊維束が細くなり、アクチン繊維束の方向が変化することがわかった。ファシンの乖離は、アクチン繊維束の形態変化を介して、細胞の機械特性に影響を与えていると予想し、AFM で弾性率(ヤング率)を計測したところ、ファシンの乖離により、弾性率が 40%減少することがわかった。ラメリポディアのファシンはがんの転移マーカーと報告されているが、細胞の弾性がファシンにより増加することが、ある種のがんの転移に関係しているのかもしれない。(Tanaka et al. Genes to Cells 24, p202-213, 2019)
目次
- 表紙の図(2018年度 第27回日本バイオイメージング学会学術集会ベストイメージング賞OLYMUPS賞受賞)
- 「成長円錐ラメリポディア領域のアクチンの束化タンパク質ファシンの機能解析」/田中みなみ・藤井裕紀・平野和巳・石川良樹・岡嶋孝治・加藤 薫 … 1
- 2019年 第28回日本バイオイメージング学会学術集会開催のお知らせ(同時開催:The 6th International Symposium on Bioimaging)/鈴木 亮・小俣大樹・船津高志・洲崎悦子・岡 浩太郎・太田善浩・鈴木和男・木原 裕・永井健治・田中直子・曽我公平・根本知己 … 2
- 日本バイオイメージング学会男女共同参画委員会の活動と2019年The 6th International Symposium on Bioimagingにおける第2回“Women in Science”開催のお知らせ/日本バイオイメージング学会男女共同参画委員会 洲崎悦子・田中直子・橋本香保子・朽津和幸・樋口ゆり子・加藤有介 … 5
- 2018年度 第27回日本バイオイメージング学会学術集会と公開講座を終えて/加藤薫 … 8
-
2018年8月発刊 2018年27巻2号(通巻83号)
-
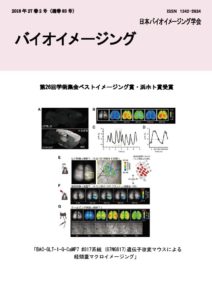
表紙: BAC-GLT-1-G-CaMP7 #817 系統経頭蓋マクロイメージング
毛内 拡、岩井 陽一、平瀬 肇
(第26回学術集会ベストイメージング賞 浜ホト賞)
脳を構成する要素として神経細胞 (ニューロン)と血管はよく知られているが、実は他にグリア細胞と呼ばれる脳細胞がある。グリア細胞の一種であるアストロサイトは脳内で、ニューロンと血管のインターフェースとして働いており、脳内環境 の維持や、ニューロンへの栄養供給などサポート的な役割を果たしている。また近年、アストロサイトが、特に生体脳にお いて、シナプス可塑性を調節している傍証がいくつも見つかってきている。
アストロサイトは、ニューロンと異なり活動電位を発生しない。そのため、従来の電気生理学的測定法では、その活動が見逃されてきた可能性がある。一方、アストロサイトは、活動に応じて細胞内Ca2+濃度を大きく変動させることが報告されている。アストロサイトのCa2+上昇は、アセチルコリンやノルアドレナリンなどの神経修飾物質によって誘起され、長時間・広範囲に渡って神経活動の調節を行なっている可能性がある。
我々は、生体脳においてアストロサイトのCa2+上昇を、広範囲・長期間に渡って可視化するために、細胞内Ca2+濃度に応答して蛍光を発するタンパク質 (G-CaMP7)をグルタミン酸トランスポーター1 (GLT-1)の下流に発現させることを試み た。試行錯誤の結果、817 系統においてG-CaMP7 の強い発現を得たが、アストロサイトのみならず一部の興奮性ニューロンにも異所的な発現が認められた (BAC-GLT-1-G-CaMP7 #817 系統遺伝子改変マウス, RIKEN BioResource Center より入手可能。Resource ID : RBRC0965)。当初、このマウスは失敗作と思われたが、大脳皮質における蛍光タンパク質 の発現が非常に強いため、蛍光実体顕微鏡下で、頭蓋骨を薄く削ることなく、大脳皮質全域の活動を可視化できることが 明らかとなった (経頭蓋マクロイメージング)。 我々はこのマウスをG7NG817 マウスと名付けた。G7NG817 マウスは、頭蓋骨越しに脳の活動が見えることから、脳機能マッピングに有効である。例えば、ヒゲ一本一本に対応するバレル皮質のニ ューロン活動など高時間・高空間分解能で可視化することができる。また、尾をつねる刺激に対しては、アストロサイト由来のゆっくりとした非常に明るいCa2+上昇が大脳皮質全域で同期して生じることが分かった。この方法を用いて、これまで我々は、経頭蓋直流電気刺激法 (tDCS)によって誘導されるシナプス可塑性にアストロサイトの Ca2+上昇が重要な役割を果たしていることを報告してきた (Monai et al., Nat. Commun. 7:11100 (2016) )。
目次
- 第27回日本バイオイメージング学会学術集会 … 15
- ご案内 … 17
- 第27回学術集会プログラム … 27
- 要旨 … 45
- 発表者索引 … 143
- 総会資料 … 151
- 学会定款 … 164
-
2018年7月発刊 2018年27巻1号(通巻82号)
-

表紙: 多点走査型2光子顕微鏡を用いたマウス膵臓におけるin vivo Ca2+イメージング
山中祐実、大友康平、後藤亜衣、中山博史、堀喬、根本知己
(第26回学術集会ベストイメージ賞ZEISS受賞)
スピニングディスクを用いた共焦点走査装置は、励起光を多点に分割して試料上を並列走査することで蛍光像の高速取得が可能である。我々は、励起光源に新規ハイピークパワー近赤外超短パルスレーザー光源を用いて多点走査型2光子顕微鏡を構築し、生体試料に対して低侵襲で、かつ、広視野と高時間分解能を有する蛍光断層像イメージング法を確立した (K. Otomo, et al., Anal. Sci., 2015, 31:307)。一方、細胞内遊離Ca2+濃度 ([Ca2+]i) の上昇が惹起する開口放出は、シナプス前終末はもとより多様な細胞の調節性分泌の基礎であり、ほぼ共通の分子機構により実現されている。膵臓腺房細胞ではコレシストキニン (CCK) 等の刺激により、腺腔への消化酵素原顆粒の [Ca2+]i 依存性開口放出が惹起される。我々は生理的な条件下での開口放出の分子機構の解明には、高速3 次元in vivo イメージングによる集団的な [Ca2+]i動態の定量的解析が重要であると考え、本研究では新規Ca2+プローブGCaMP7 を細胞質中に発現するGLT1-GCaMP7マウス (G7NG817、kCa = 243 nM、理研BSI・平瀬肇博士より) を用い、膵臓外分泌腺房のCa2+応答の可視化解析法の確立を目指した。先ず、呼吸や心拍を抑制して、麻酔下のまま倒立顕微鏡ステージ上で臓器を保定する機構を導入した。その結果、安定的なin vivo 観察を実現し、膵臓で深さ 50 μm までの 3 次元的光学断層像イメージングに成功した。次に、尾静脈にカニューレを挿入し、撮像中に血中最終濃度を任意の値に調整できる様にCCK-オクタペプチド(CCK-8) 溶液を投与することで、膵臓におけるCa2+振動の広視野、高速かつ 3 次元的な取得が可能であることを確認した。CCK-8 の血中濃度が 1 → 2.5 → 50 → 1000 pM となる様、30 分毎に段階投与したところ、励起光の断続的な照射による組織の障害や蛍光色素の褪色を抑えたまま、同一の観察視野で約 90 分間に渡り、3 次元的に撮像することに成功した (図)。その結果、in vivo でも急性単離標本と同様にアゴニスト濃度依存的なCa2+応答が確認された。一方、in vivo ではアゴニスト感受性自体は昂進し、また細胞間でのCa2+振動の同期性が向上している可能性が示唆された。本方法論は、生体内で真のシグナル動態を定量的に可視化解析でき、生理機能の基盤に関する新知見を与えることが期待される。
目次
- 表紙の図(第26回学術集会ベストイメージ賞ZEISS受賞)
- 「多点走査型2光子顕微鏡を用いたマウス膵臓におけるin vivo Ca2+イメージング」/山中祐実・大友康平・後藤亜衣・中山博史・堀 喬・根本知己 … 1
- 第27回日本バイオイメージング学会学術集会のご案内/加藤 薫 … 2
- 第26回日本バイオイメージング学会学術集会を終えて/小島正樹 … 6
- 研究室だより 熊本大学 檜垣研究室/檜垣 匠 … 8
-
2017年8月発刊 2017年26巻2号(通巻81号)
-
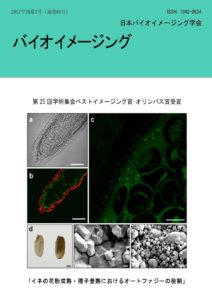
表紙: イネの花粉成熟・種子登熟におけるオートファジーの役割
桧垣匠,秋田佳恵,朽名夏麿来須孝光、花俣繁、瀬良ゆり、澤田隼平、陶文紀、坂本真吾、小野聖二郎、小嶋美紀子、榊原均、野々村賢一、光田展隆、朽津和幸,馳澤盛一郎
(第25回学術集会ベストイメージング賞オリンパス賞受賞)
オートファジーによる細胞質成分の分解は、真核生物の発生・分化やプログラム細胞死(PCD)に重要な役割を果たす。葯のタペート細胞は花粉への脂質を含めた栄養供給を担う組織で、花粉成熟期に PCD により消失する。イネの小胞子一核期(PCD 開始期)のタペート細胞においてオートファジーが誘導される。またイネのオートファジー欠損変異株(Osatg7-1)では、タペート細胞のPCD が抑制され、花粉形成不良による重篤な雄性不稔形質を示すことが判明している(Autophagy 10, 878-888 (2014); Front. Plant Sci. 5, e457 (2014); Bioimages 24, 1-11 (2016); J. Plant Res. 130, 491-499 (2017))。我々は、タペート組織的プロモーターと GFP-ATG8 オートファジー可視化マーカータンパク質を組み合わせた定量的蛍光イメージング実験系を構築し、花粉発達期におけるタペート細胞内のオートファジー動態を詳細に解析した。また、葯の植物ホルモン成分解析の結果、花粉発達に必須な植物ホルモンであるジベレリン(GA)含量が Osatg7-1 では低下し、外部から GA を添加することにより、Osatg7-1 の花粉発芽能が部分回復した(Plant Signal. Behav. (2017) 印刷中)。一方、Osatg7-1 において低頻度で稔実した種子は白濁し、澱粉蓄積に異常を示すくず米様の表現型を示したことから、オートファジーは、受精後のイネ登熟過程における栄養供給にも関与する可能性が考えられる。現在、タペート細胞の PCD 制御におけるオートファジー誘導、活性酸素(ROS)シグナルの相互関連性について解析を進めるとともに、イネ登熟過程における糖・澱粉代謝でのオートファジーの生理学的役割についても検証し、オートファジーの農業的重要性を明らかにすべく研究を進めている。
図の説明:
イネのタペート細胞におけるオートファジー動態(a-c).オートファゴソーム由来のドット状のGFP 蛍光が葯内のタペート細胞特異的に観察される(a, c).赤色蛍光は、タペート外層の中間層細胞に存在する葉緑体の自家蛍光(b).イネ登熟種子と胚乳断面の SEM 画像(d-f)。Osatg7-1 種子は白濁し(d)、野生型株に比べて澱粉粒の微細化が観察される(e, f).Scale bar:50 mm (a, b)、25 mm (c)、1 cm (d)、2 mm (e, f).目次
- 第26回日本バイオイメージング学会学術集会 … 19
- ご案内 … 21
- 第26回学術集会プログラム … 27
- 要旨 … 39
- 発表者索引 … 109
- 総会資料 … 114
- 学会定款 … 128
-
2017年7月発刊 2017年26巻1号(通巻80号)
-
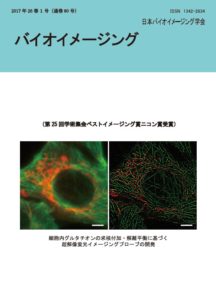
表紙: 細胞内グルタチオンの求核付加・解離平衡に基づく超解像蛍光イメージングプローブの開発
両角明彦、神谷真子、宇野真之介、梅澤啓太郎、吉原利忠、飛田成史、浦野泰照
(第25回学術集会ベストイメージング賞ニコン賞受賞)
超解像蛍光イメージング法は、光学顕微鏡の空間分解能の限界を超えた画期的なイメージング技法であり、その1 つに、蛍光プローブを確率的に明滅させて1 分子ずつ高精度に位置決定することで超解像画像を構築するsingle-moleculelocalization microscopy (SMLM) という手法がある。しかしながら、一般的な蛍光色素を明滅させるには添加剤や強いレーザー光照射が必要であり、細胞毒性や蛍光色素の光褪色が問題となる。これに対し、当研究グループでは、分子内スピロ環化平衡を原理として、添加剤や高強度レーザーによらず自発的に明滅する赤色蛍光ローダミン色素HMSiR を開発している (Nature Chem. 6, 681?689 (2014)) 。さらに今回、多様な波長や明滅特性への要請に幅広く対応するべく、上記分子設計を拡張した柔軟かつ効率的な新規設計原理の確立を試みた。生理的条件下で機能する新たな蛍光明滅原理として、細胞内求核種であるグルタチオン (GSH)が色素分子に対して示す可逆的な求核付加・解離平衡の利用に着目した。そこでまず、種々の候補色素化合物を合成し、上記平衡における蛍光性状態の存在比率および蛍光性状態の持続時間といった明滅特性を評価した結果、生細胞内環境下でのSMLM に最適な特性を示す2 色の蛍光色素を見出した。続いて、これらの色素を蛍光顕微鏡下で評価した結果、生理的濃度のGSH 存在下で、他の添加剤や強いレーザー光照射によらない自発的な蛍光明滅を確認した。さらに、このような蛍光明滅は、固定細胞内の標的構造をラベルした場合においても認められ、その標的の超解像画像を与えることが確かめられた。表紙の画像は固定細胞の微小管およびミトコンドリアをそれぞれ免疫染色して2 色でのSMLM を実施した結果である。さらに最近、これらの色素の生細胞応用にも成功している。添加剤や高強度レーザー光照射を用いない穏和な条件での生細胞SMLM を達成しており、現在、生細胞2 色SMLM 等の様々な観察実験系への応用を進めている。
目次
- 表紙の図(第25回学術集会ベストイメージング賞ニコン賞受賞)
- 「細胞内グルタチオンの求核付加・解離平衡に基づく超解像蛍光イメージングプローブの開発」/両角明彦・神谷真子・宇野真之介・梅澤啓太郎・吉原利忠・飛田成史・浦野泰照 … 1
- 第26回日本バイオイメージング学会学術集会「公開講座」並びに「学術講演会」のお知らせ/小島正樹 … 2
- 第25回日本バイオイメージング学会学術集会を終えて/加藤晃一 … 5
- 第5回国際バイオイメージングシンポジウム:
The 5th International Symposium for Bioimaging-Singapore, May 20-21,2007 = Joint Symposium on Bioimagingを終えて/鈴木和男・船津高志・石渡信一・永井健治・藤田克昌・上田泰己・西村 智・岡 浩太郎・木原 裕・鈴木 亮・川久保愛美・島 忠光・Hossain Md. Nadim・桧垣 匠・宗像理紗・日本バイオイメージング学会男女共同参画委員会 … 6 - “Women in Science”を企画・実現して/田中直子・橋本香保子・政池知子・伊香賀玲奈・洲埼悦子・朽津和幸・樋口ゆり子・加藤有介 … 14
- 日本バイオイメージング学会の新しいホームページのご案内/「バイオイメージング」投稿のお誘い … 16
-
2016年8月発刊 2016年25巻2号(通巻79号)
-
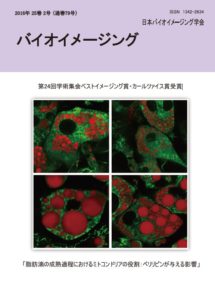
表紙:脂肪滴の成熟過程におけるミトコンドリアの役割:ペリリピンが与える影響
長谷川千織,伊香賀玲奈,田中光,田中直子
(第24回学術集会ベストイメージング賞(カールツァイス賞)受賞)
脂肪細胞が肥大化するとサイトカインの合成・分泌が促され、脂肪細胞の周辺に炎症を引き起こし、生活習慣病の原因になると言われている。ミトコンドリアについては近年活発に研究が進められ、周囲の状態に合わせて形態を変化させながら積極的に細胞内の機能をコントロールする細胞内小器官であることがわかってきているが、脂肪細胞においてどのような役割を担っているかについての研究はまだ非常に少ない。そこで本研究では脂肪細胞における脂肪滴とミトコンドリアの相互関係を明らかにする手がかりとして、脂肪滴表面に存在するペリリピンに着目した。表紙の図は、脂肪滴の成熟過程に関わりがあると考えられるペリリピン4 をノックダウンした時の脂肪滴とミトコンドリアを観察したものである。
マウス線維芽細胞3T3-L1 に、ペリリピン4 に対するshRNA を導入後にG418 を用いてペリリピン4 を定常的にノックダウンした細胞を選択し、これをshPLIN4 とした。shPLIN4 を脂肪細胞に分化させ、分化誘導後8 日目、18 日目のミトコンドリアと脂肪滴の可視化を試みた。ミトコンドリアは形がよくわかるコントロールに対し、shPLIN4 では細くて鮮明でない様子が観察された。また、分化誘導後18 日目ではコントロールの脂肪滴の周辺にミトコンドリアが集まる様子が観察されたが、shPLIN4 ではこのような傾向はみられなかった。脂肪滴は日数が経つと大きくなるコントロールに対し、shPLIN4 では大きな脂肪滴とともに多数の小さな脂肪滴が存在する様子が観察された。
目次
- 第25回日本バイオイメージング学会学術集会 … 41
- ご案内 … 43
- 第25回学術集会プログラム … 49
- 要旨 … 60
- 発表者索引 … 138
- 総会資料 … 143
- 学会定款 … 157
-
2016年6月発刊 2016年25巻1号(通巻78号)
-
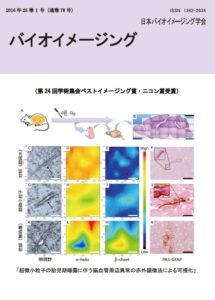
表紙: 超微小粒子の胎児期曝露に伴う脳血管周辺異常の赤外顕微法による可視化
小野田淳人、川﨑平康、築山光一、武田 健、梅澤雅和
(第24回学術集会ベストイメージング賞(ニコン賞)受賞)
目次
- 表紙の図「超微小粒子の胎児期曝露に伴う脳血管周辺異常の赤外顕微法による可視化」(第24回学術集会ベストイメージング賞受賞)/小野田淳人・川﨑平康・築山光一・武田 健・梅澤雅和 … 1
- 2016年度 第25回日本バイオイメージング学会学術集会のお知らせ/加藤晃一 … 2
- 2015年度 第25回日本バイオイメージング学会学術集会・公開講座を終えて/朽津和幸 … 5
- 生命科学分野の細分化と再編成:バイオイメージングのこれから~第24回学術集会シンポジウム 「NO DIVISION, NO LIFE..動物と植物の細胞分裂イメージング最前線」を終えて~/桧垣匠・岡部弘基 … 7
- SBWイメージングの現状と課題/曽我公平 … 9
- NIR-II波長域を用いたマウス in vivo 蛍光イメージングの可能性/竹内 司・大谷敬亨・上村真生 …. 11
- 希土類ナノ粒子OTN近赤外蛍光プローブによるマウス in vivo イメージングの応用/岸本英博・福田啓介・竹下寛之・曽我公平 … 16
- 「第2の生体の窓」におけるカーボンナノチューブの発光/岡﨑俊也 … 19
- 動物体内におけるナノ粒子の未知なる動態メカニズムと検出技術改善のニーズ/梅澤雅和・新海雄介・小野田淳人・武田 健・上村真生・曽我公平 … 22
- オーバービュー:「感染症を見る」を開催するにあたって/鈴木和男 … 28
- 最小イオンチャネルHv1/VSOPによる貪食細胞の活性酸素産生の多重制御/岡村康司・大河内善史・荒谷康昭・Hibret A. Adissu・鈴木和男 … 29
- トリインフルエンザH5N1を高病原性化するNon-structural protein 1における変異のタンパク質分子機構/加藤有介・福井 清・鈴木和男 … 30
- 植物の感染防御応答の制御と細胞内の膜動態/朽津和幸・大滝 幹・羽山大介・北畑信隆・花俣 繁・来須孝光・上田貴志 … 31
- 蛍光イメージングによる神経細胞内マグネシウムイオン動態の解析/新藤 豊・山中 龍・鈴木孝治・岡浩太郎 … 32
- 「バイオイメージング」投稿のお誘い … 38
-
2015年9月発刊 2015年24巻2号(通巻77号)
-
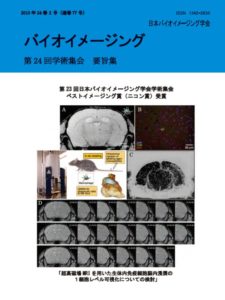
表紙:超高磁場MRIを用いた生体内免疫細胞脳内浸潤の1細胞レベル可視化についての検討
森勇樹,陳挺,大野工司,吉田慎一,多胡善幸,小橋昌司,畑豊,吉岡芳親
(第23回学会学術集会ベストイメージング賞(ニコン賞)受賞)
中枢神経系は免疫特権の器官と長く考えられてきたが,最近の研究で,免疫細胞が多くの神経関連疾患の発生に重要な役割を担うことが分かりつつある.免疫細胞は,恒常性の目印となる因子群のレベルに異常がないか,脳の微小血管系を常時監視している.異常があった場合,免疫反応が始まり,中枢神経系内のミクログリアの動員,または抹消からの免疫系細胞の浸潤,あるいはその両方が起こる.しかし,正常状態・疾病状態での免疫細胞の動態には,不明な点が多い.それは,生きた組織内での細胞の動きを,低侵襲で長期にわたって可視化することが難しかったためである.今回,マウス生体脳内の細胞移動を単一細胞レベルで連続的に追跡する目的で,高感度生体MRI(磁気共鳴イメージング)技術を開発した.MRIと超常磁性酸化鉄ナノ粒子(SPIO)の血管内投与を組み合わせることで,末梢の貪食細胞が,正常およびリポ多糖投与マウスの脳内部に移行する様子を追跡できた.また,MRIのタイムラプス動画により,生きた動物脳内での細胞移動の様子を示すことにも成功した.タイムラプスMRIでは,コントロールマウス脳内でゆっくりと動いている細胞の可視化・追跡も可能である.SPIOを利用した高感度MRI細胞追跡技術は,脳内の免疫細胞の動態とCNSの恒常性維持機構について,新たな視座を提供することが期待できる.
目次
- 第24回日本バイオイメージング学会学術集会 … 31
- ご案内 … 33
- 第24回学術集会プログラム … 39
- 要旨 … 53
- 特別展示のご案内 … 157
- 発表者索引 … 165
- 総会資料 … 171
- 学会定款 … 183
- 協賛企業一覧 … 189
-
2015年6月発刊 2015年24巻1号(通巻76号)
-
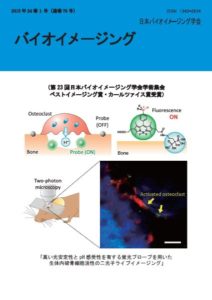
表紙:高い光安定性とpH感受性を有する蛍光プローブを用いた生体内破骨細胞活性の二光子イメージング
前田拓樹,小和田俊行,菊地和也
(第23回学会学術集会ベストイメージング賞(カールツァイス賞)受賞)
破骨細胞による骨吸収は、骨組織の成長や修復の際に、骨密度や形状を調節するために必要不可欠な生体機能である。その一方で、過剰な骨吸収は、骨粗しょう症や関節リウマチといった骨疾患を引き起こす。そのため、骨疾患に対する新薬開発や治療法を確立する上で、生体内における破骨細胞動態を解析可能な蛍光イメージング技術の開発が求められている。そこで我々は、活性化破骨細胞が骨表面上に酸性領域を形成することに着目し、①低pH 環境下で蛍光がONになる蛍光スイッチ機能と、②骨表面への選択的送達能を有する蛍光プローブを開発した。プローブを皮下注射によりマウスに投与し、骨組織を二光子励起顕微鏡により観察したところ、一部の破骨細胞直下からプローブ由来の蛍光シグナルが観察された。これは、開発したプローブが活性化破骨細胞により形成された酸性領域を選択的に可視化可能であることを示している。このように、本研究では、機能性蛍光プローブと二光子励起顕微鏡を組み合わせることよって、破骨細胞動態を詳細に解析可能であることを明らかにした。
(左上)pH 感受性蛍光プローブによる破骨細胞活性検出の概念。破骨細胞の酸性領域でのみプローブ蛍光が ON となり、骨吸収を選択的に可視化可能となる。
(右上)pH 感受性と骨選択的送達能を有するプローブ構造。BODIPY 色素を母骨格に持ち、光誘起電子移動による pH感受性機能を有す。骨に対する親和性の高いビスホスホネート構造を導入し、生体中の骨組織に対する選択的送達能を付与した。
(下)マウス頭頂骨の二光子励起顕微鏡による蛍光イメージング像。赤色:破骨細胞、青色:骨組織、緑色:プローブ。
Kowada, T. et al. J. Am. Chem. Soc. 2011, 133, 17772 より一部改変して掲載。Scale bar: 40 um
目次
- 表紙の図「高い光安定性とpH感受性を有する蛍光プローブを用いた生体内破骨細胞活性の二光子イメージング」(第23回学術集会ベストイメージング賞)/ 前田拓樹・小和田俊行・菊地和也
- 第24回日本バイオイメージング学会学術集会のお知らせ/第24回日本バイオイメージング学会学術集会・大会長 朽津和幸 … 2
- イネの生殖器官発達におけるオートファジーの新たな役割/来須孝光・花俣繁・小谷野智子・朽津和幸 … 7
- ルシフェラーゼを用いた細胞レベルの遺伝子発現動態解析/今井章裕・村田隆・長谷部光泰 … 12
- 光退色後蛍光回復法(FRAP)を用いたタンパク質動態解析の実際と2光子励起法の利用/ 村田隆 … 17
- 蛍光寿命や近赤外光を応用したイメージング技術/三輪佳宏・田中順子・千田直子・黒山喬允・逆井智貴・濱田理人・百武篤也・新井達郎・高橋智 … 22
- 投稿規定と協賛学会のお知らせ … 28
-
2014年8月発刊 2014年23巻2号(通巻75号)
-
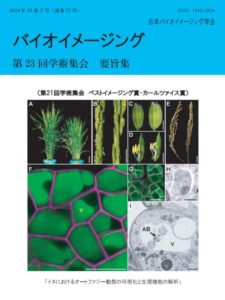
表紙:イネにおけるオートファジー動態の可視化と生理機能の解析
小谷野智子,来須孝光,花俣繁,八木智華子,池田晃子,野口祐平,永田典子,朽津和幸
(第21回学会学術集会ベストイメージング賞(カールツァイス賞)受賞)
オートファジーは、細胞質中に内膜系(オートファゴソーム)が生成され、液胞やリソソームと融合することにより、細胞成分が分解される自食作用であり、近年、酵母や動物細胞を中心に分子機構の解明が進められている。しかしながら、植物の発生における役割は未解明な部分が多かった。我々は、GFP-ATG8 タンパク質を用い、穀物モデルのイネにおけるオートファジー可視化実験系を構築すると共に、オートファジー欠損変異株利用し、その生理的役割の解明を目指した。生活環を通して変異体の表現型を観察した結果、ホモ変異体は、出穂や開花の遅延を示すと共に、劇的な不稔形質を示すことが明らかになった。電子顕微鏡法により、葯の各組織のオートファジー動態を解析した結果、花粉への栄養や表面構造の材料供給組織であるタペート細胞において、減数分裂期後にオートファジーが誘導されることが明らかになった。本研究の一部は、Kurusu et al. Autophagy 2014 10(5):878-888 に掲載され、画像は同論文から一部改変して掲載した。
(A, B):オートファジー欠損による出穂・開花の遅延(野生型(左)と変異体(右))。
(C, D):オートファジー能を消失させても、器官セットに影響は見られない(野生型(左)、変異体(右))。
(E):オートファジー欠損は、穀物イネにおいて、劇的な不稔を引き起こす(野生型(左)、変異体(右))。
(F):飢餓条件による、GFP-AtATG8 蛍光の液胞への蓄積(野生型、コンカナマイシン A存在下) 。
(G):欠損株では、液胞への蛍光蓄積が観察されない (コンカナマイシン A 存在下)。
(H):イネ培養細胞(野生型)において観察されたオートファゴソーム様構造体の透過電子顕微鏡像。
(I):液胞内に輸送された細胞質成分を含むオートファジックボディ(野生型、コンカナマイシン A 存在下)。
Scale bar: (A) 10 cm, (B) 1 cm, (C, D) 2 mm, (E) 2 cm, (F, G) 20 μm, (H) 500 nm, (I) 2 μm,
V; 液胞, AB; オートファジックボディ
目次
- 第23回日本バイオイメージング学会学術集会 … 33
- ご案内 … 35
- 第23回学術集会プログラム … 40
- 要旨 … 52
- 総会資料 … 134
- 日本バイオイメージング学会入会のお願い … 146
- 学会定款 … 149
-
2014年6月発刊 2014年23巻1号(通巻74号)
-
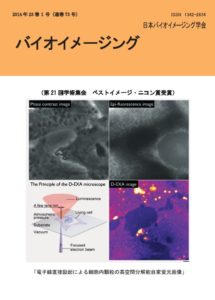
表紙:電子線直接励起による細胞内顆粒の高空間分解能自家蛍光画像
名和靖矩,居波渉,小野篤史,三宅亜紀,林升,川田善正,寺川進
(第21回学術集会ベストイメージング賞(ニコン賞)受賞)
我々は集束した電子線で蛍光体を直接励起する高空間分解能蛍光顕微鏡システム:D-EXA(Direct electron-beam excitation assisted optical)顕微鏡を開発してきた。本手法では生きたままの生体試料を数十 nm の高空間分解能で、かつリアルタイムで観察することができる。電子線が透過可能な薄膜を用いて試料環境と真空を分離するため、薄膜を介して、試料中の蛍光体を数十 nm のスポットサイズで直接励起できる。本顕微鏡を用いて、液中のHeLa 細胞の自家蛍光観察を行った。真空と大気を分離する薄膜基板上に細胞を培養し、染色処理を行わずに電子線で励起した。その結果、落射蛍光顕微鏡では観察できない細胞内微小顆粒や細胞膜からの自家蛍光を高コントラスト、高空間分解能で観察できた。
左上図: HeLa 細胞の位相差顕微鏡画像
右上図: 同細胞の落射蛍光顕微鏡画像
(励起波長 530-550 nm, 観察波長 > 575 nm)左下図: D-EXA 顕微鏡の原理図
右下図: 同細胞のD-EXA 顕微鏡画像
(擬似カラー) スケールバー: 2 μm目次
- 第23回日本バイオイメージング学会学術集会 「公開講座」並びに「学術講演会」のお知らせ/ 第23回日本バイオイメージング学会学術集会・大会長 菊地和也 … 1
- 第22回日本バイオイメージング学会学術集会報告/ 第22回日本バイオイメージング学会学術集会・大会長 船津高志 … 5
- 植物の孔辺細胞をモデルとした蛍光タンパク質の統計的局在解析/ 桧垣匠 … 6
- 測定装置としての顕微鏡を用いた生物機能の解析/ 村田 隆・稲田のりこ・朽津和幸 … 11
- 蛍光相関分光法とFRETを用いた細胞内タンパク質品質管理機構の解析/ 北村朗 … 12
- 細胞の温度を測る/ 稲田のりこ・林晃之・福田七穂・内山聖一 … 18
- 植物のオートファジー動態の簡便な定量解析/ 花俣 繁・来須孝光・朽津和幸 … 23
- 「バイオイメージング」執筆要項 … 28
-
2013年8月発刊 2013年22巻2号(通巻73号)
-
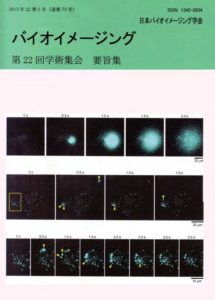
表紙:分泌タンパク質のビデオレート生物発光イメージング
鈴木崇弘,近藤千裕,金森孝雄,井上敏
(第21回学術集会ベストイメージング賞(OLYMPUS賞)受賞)
我々が開発してきた分泌タンパク質の生物発光イメージング法は,開口分泌されたルシフェラーゼ(酵素)と細胞外液に添加したルシフェリン(基質)の発光反応に基づいている.本手法は,発光強度によるタンパク質分泌の定量化が可能であり,さらに,単一生細胞における全細胞表面の解析が可能である.Gaussia luciferase(GLase)をレポーターとしてEM-CCDカメラで発光を検出することにより,生細胞におけるタンパク質分泌をビデオレート(0.03-0.5秒/フレーム)で30分以上可視化できる.本研究では,癌の浸潤と転移に関与するmatrix metalloproteinase-2についてGLase融合タンパク質(MMP2-GLase)を用いた分泌動態の解析を行った.
図:GLaseまたはMMP2-GLaseを発現させたHeLa細胞の発光ビデオ画像(露光時間0.5秒)を取得し,明視野画像に重ねた.40倍油浸対物レンズ(NA1.30)を使用した.開口分泌により出現した発光シグナル(シアン)を矢印(黄)で示した.
上段:GLase分泌の連続画像.細胞の情報側に拡散する様子が観察された.
中段:MMP2-GLase分泌の連続画像.遊走細胞の先導端と退縮端(細胞底面側)に分泌が局在し,先導端での積極的な開口分泌が認められた.
下段:中段の枠(黄)で囲んだ領域におけるMMP2-GLase分泌の連続画像.先導端に沿う一過性の連続的な開口分泌が観察された.
Suzuki, T., et al., PLOS ONE, 6, e25243, 211より改変.
目次
- 第22 回日本バイオイメージング学会学術集会 … 33
- ご案内 … 35
- 第22 回学術集会プログラム … 43
- 要旨 … 58
- 発表者索引 … 206
- 総会資料 … 213
- 学会定款 … 229
-
2013年6月発刊 2013年22巻1号(通巻72号)
-

表紙:葉表面の細胞輪郭抽出と細胞形態計測
桧垣匠,秋田佳恵,朽名夏麿,馳澤盛一郎
(第21回学術集会ベストイメージング賞(ベストイメージ・晝馬賞)受賞)
細胞運動能を有しない植物細胞の場合,細胞形態は細胞壁成分の再編成による細胞壁の物性変化と細胞分裂に伴って出現する細胞板の癒合位置によって規定される.細胞壁によって規定される細胞形状は個別の細胞機能に加えて,器官全体の形態形成にも多大な影響を及ぼすものと考えられる.そこで本研究では,シロイヌナズナの子葉を材料とし,葉の発生に伴う表皮細胞の変形様式を捉えることを目的とした.まず,発芽後2-14日目における芽生えの背軸側の子葉表皮の細胞膜を蛍光標識し,高解像度の細胞輪郭像を取得する実験系を確立した.得られた細胞輪郭画像から細胞の複雑度,細胞長軸の向きを測定したところ,表皮細胞は湾曲を伴いながら,葉全体における自身の位置を認識して各々の方向へ伸長することで円い葉型を実現することが示唆された.本号p. 10~16の「Walking on leaf: 葉表皮細胞の輪郭線抽出と形態計測」参照.
上段:シロイヌナズナ子葉の拡大に伴う表皮細胞の複雑度の推移.
下段:シロイヌナズナ子葉の拡大に伴う表皮細胞の細胞長軸の向きの推移.目次
- 「バイオイメージング」の新しい刊行体制について/ 朽津和幸 … 1
- 観るだけでなく測る:定量的イメージングによる細胞機能解析/ 岡部弘基 … 2
- Walking on leaf: 葉表皮細胞の輪郭線抽出と形態計測/ 桧垣匠 … 10
- 学会からのお知らせ: 第22回日本バイオイメージング学会学術集会 「公開シンポジウム」並びに「学術講演会」のお知らせ … 17
- 研究室だより: 東京理科大学曽我研究室/ 曽我公平 … 23
- 「バイオイメージング」執筆要項 … 28
投稿規定
①本誌は、日本バイオイメージング学会の高い学際性に基づき、バイオイメージング及び関連領域に関する、広範な専門分野の研究者や学生が理解しやすい和文の原著論文、総説、解説等を掲載する。また、会員が所属する研究室や研究機関の紹介記事等を掲載する。論文等は、編集委員と当該分野の専門家が審査を行い、編集委員会が採否を決定する。本誌に掲載された著作物の著作権は、日本バイオイメージング学会に帰属することを前提とする。
②他の雑誌・書籍等にすでに掲載された内容を含む原稿や、他の雑誌等に投稿中の原稿は、原著論文として投稿できない。総説、解説等において、図・表・文章など出版済みの内容を転載する場合は、投稿前に著作権所持者の許可を取ること。これらの規定に反した場合、また、データの捏造や他の著作物からの盗用など、科学的ないし社会的倫理に反する行為が判明した場合には、編集委員会は掲載決定後あるいは掲載後においてもその原稿の掲載取り消しを行うことができる。
③投稿原稿の体裁は次のとおりとする。
1.テキストは、原則としてMS-Word 形式のファイルとする。
2.原稿の最初に、表題、著者氏名、所属先、電子メールアドレスを記載する。また原則として要旨を付ける。
3.A4 版で6 ページ以内を標準とする。原則として和文フォントはMS 明朝、英文はTimes New Roman またはTimesを用いる。余白は上下25 mm、左右20 mm、タイトル・著者氏名・所属・要旨は全段、本文は2 段組として、40 行/ページ、行送り17.5 pt とする。タイトルは12 ポイント、執筆者氏名・所属・本文は9 ポイントを用いる。図表等は、必要に応じて2 段組にせず、全段で掲載することも可能。
4.図・写真・表・図の説明文は、ファイル本文中の希望箇所に挿入し、8 ポイント、原則として和文フォントはMSゴシック、英文はArial を用いる。
④投稿にあたっては、投稿原稿のファイル(MS-Word形式とpdf 形式の双方; 図、写真の元データファイル(300dpi 以上の解像度)を含む)を日本バイオイメージング学会「バイオイメージング」編集長宛に、電子データとして送付する。
⑤校正は、著者の責任において行う。
⑥著者の希望によりカラー印刷する場合の別途費用は、著者負担とする。 別刷を50 部単位で購入することができる。
原稿送付先
〒860-8555 熊本県熊本市中央区黒髪2-39-1
熊本大学 大学院先端科学研究部
日本バイオイメージング学会「バイオイメージング」編集長 檜垣 匠
Email:thigaki@kumamoto-u.ac.jp
(spam対策で@を全角にしています。お送りいただくときは、半角@にして下さい。)